PROCESO ISOCORICO:
Un proceso isocórico, también llamado proceso isométrico o isovolumétrico es un proceso termodinámico en el cual el volumen permanece constante; ΔV = 0. Esto implica que el proceso no realiza trabajo presión-volumen, ya que éste se define como:
- ΔW = PΔV,
donde P es la presión (el trabajo es positivo, ya que es ejercido por el sistema).
En un diagrama P-V, un proceso isocórico aparece como una línea vertical.
proceso isobárico
Un proceso isobárico es un proceso termodinámico que ocurre a presión constante. La Primera Ley de la Termodinámica, para este caso, queda expresada como sigue:
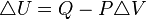 ,
,Donde:
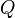 = Calor transferido.
= Calor transferido. = Energía Interna.
= Energía Interna.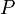 = Presión.
= Presión. = Volumen.
= Volumen.
En un diagrama P-V, un proceso isobárico aparece como una línea horizontal.
procesos adiabatico
En termodinámica se designa como proceso adiabático a aquél en el cual el sistema (generalmente, un fluido que realiza un trabajo) no intercambia calorcon su entorno. Un proceso adiabático que es además reversible se conoce como proceso isentrópico. El extremo opuesto, en el que tiene lugar la máxima transferencia de calor, causando que la temperatura permanezca constante, se denomina como proceso isotérmico.
El término adiabático hace referencia a elementos que impiden la transferencia de calor con el entorno. Una pared aislada se aproxima bastante a un límite adiabático. Otro ejemplo es la temperatura adiabática de llama, que es la temperatura que podría alcanzar una llama si no hubiera pérdida de calor hacia el entorno. En climatización los procesos de humectación (aporte de vapor de agua) son adiabáticos, puesto que no hay transferencia de calor, a pesar que se consiga variar la temperatura del aire y su humedad relativa.
El calentamiento y enfriamiento adiabático son procesos que comúnmente ocurren debido al cambio en la presión de un gas. Esto puede ser cuantificado usando la ley de los gases ideales.

No hay comentarios:
Publicar un comentario